物性 / H₂O 水 イオン積
全体観把握目的で多種公表情報を基に作成、整合性無い場合もあります。自ら検証して御使用下さい。
全体観把握目的で多種公表情報を基に作成、整合性無い場合もあります。自ら検証して御使用下さい。
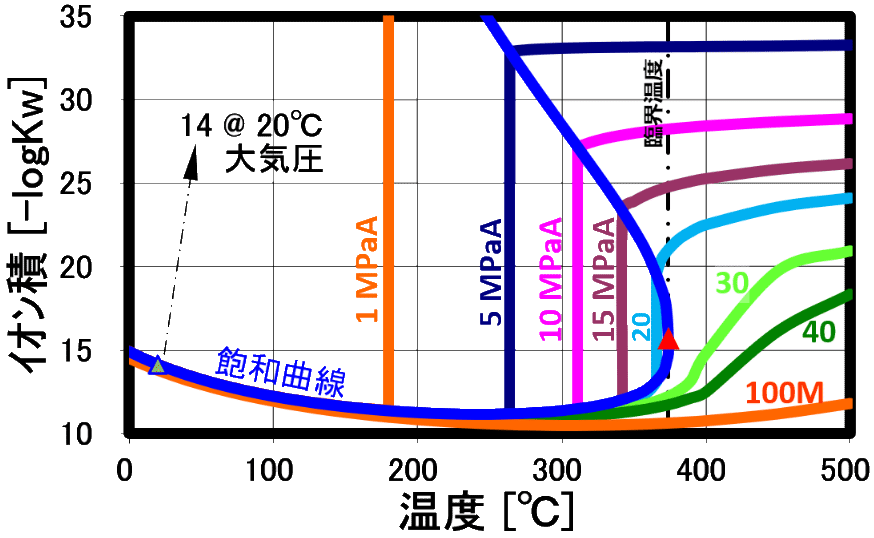
・ 高圧水は温度の上昇と共にイオン積が大幅に増加し、極大値が存在。
このため、電解質溶媒としてイオン反応(加水分解反応)に好都合な反応場を提供すると共に制御できる溶媒として利用されています。解離が進み水自体が酸やアルカリの機能を示し、加水分解作用が大きくなります。
このイオン積は、250℃近辺で最大値(図は-logのため最小値)を示し、高圧になると共にその最大値を示す温度は300℃に近づきます。
更に温度を上げるとイオン積は急激に小さくなり、ガス的性質が強くなります。
このため、縮重合物の加水分解反応を行う場合には、250℃近辺で、圧力は10MPa程度で行うのが、効率的になります。
即ち、この観点では、超臨界水よりも亜臨界水の方が反応特性が良い結果になります。
(常温の水は、Kw=-14[(mol/kg)2]、250℃の高圧水は、Kw=-11で、 [H+]・[OH-]が1,000倍増加します)
・ イオン積が最大値を示すよりも、更に温度上昇させると、密度低下によりイオン積が減少しますが、逆にこの領域ではラジカル反応が支配的になります。この時、超臨界水のような高密度の不活性物質が存在する事で、ラジカル反応でも反応経路や生成物分布の制御が期待されます。
イオン積 [Kw] = [H+]・[OH-] = [10-7]・[10-7] = 10-14 @ 25℃、大気圧 → -log(Kw) = 14
・ 以下のイオン積の図は、1999 日本機械学会 蒸気表 JSME STEAM TABLES Based on IAPWS-IF97の表を図示したものです。臨界点▲は、374℃、15.7です。
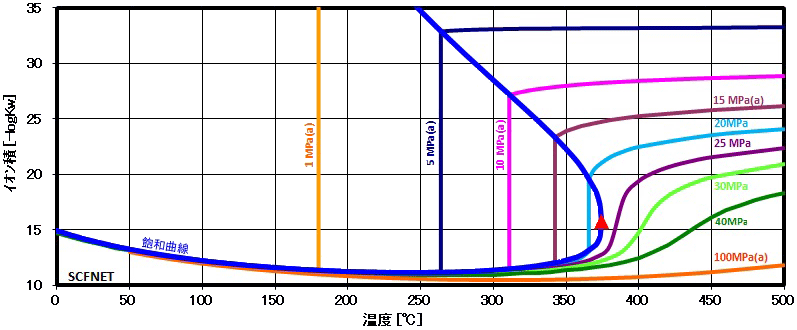
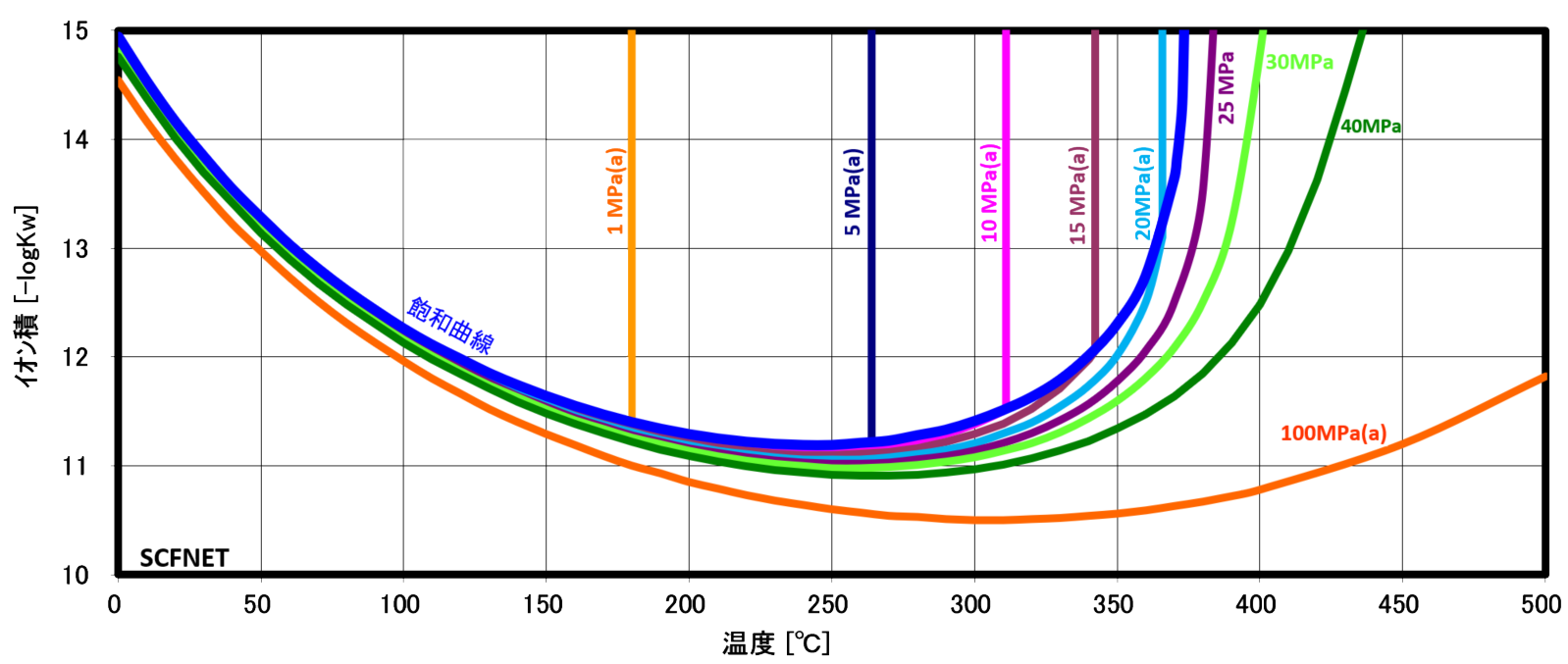
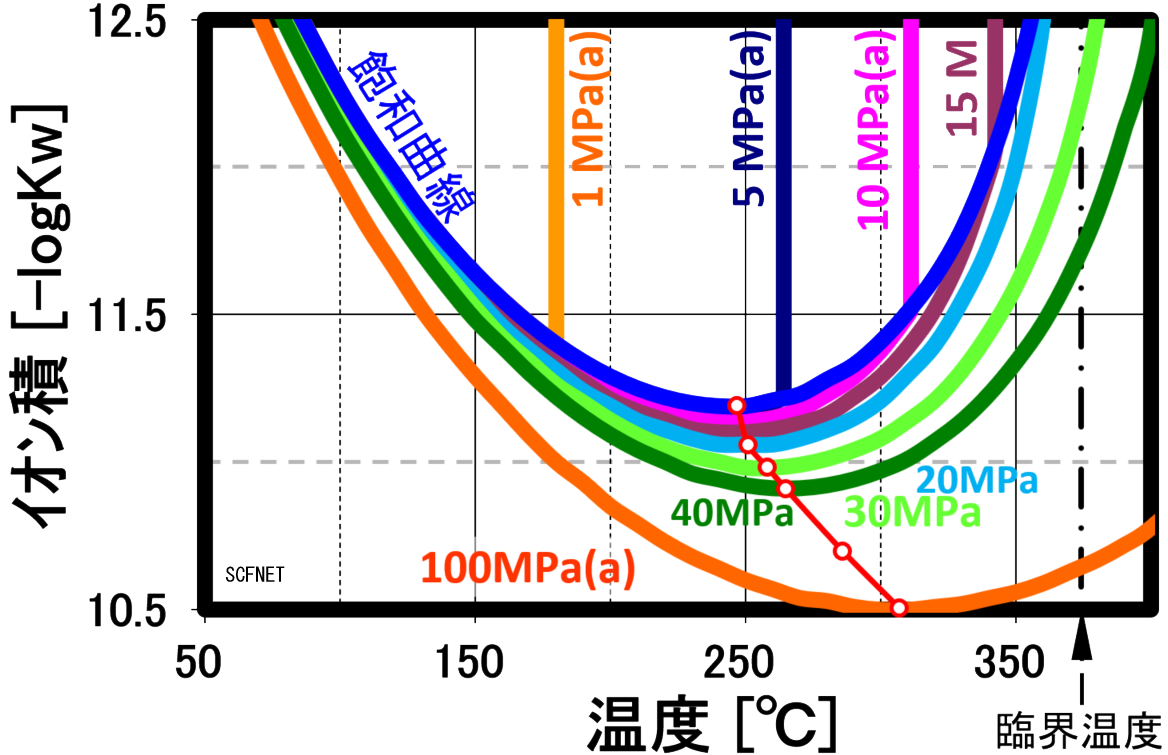
イオン積は左図に示すように250℃近辺で最大値 (図は-logのため最小値)を示し、高圧程その最大値を示す温度、極大値軌跡は、左図の赤〇線に示すように変化し、 300℃に近づきます。
| 圧力 | 温度 | イオン積 |
| [MPaA] | [℃] | -logKw |
| 3.77 | 246.85 | 11.19 |
| 20 | 251 | 11.06 |
| 30 | 258 | 10.98 |
| 40 | 265 | 10.91 |
| 70 | 286 | 10.70 |
| 100 | 307 | 10.50 |
注記:上表イオン積の最大値は、国際蒸気・水性質協会から提案されたイオン積の計算式を基に最大値を試算したものです。
参考文献:https://www.jstage.jst.go.jp/article/jcorr1991/47/5/47_5_298/_pdfの1.3項